日前,我校理学院郭红超教授课题组在不饱和碳不对称烯丙基化反应研究中取得重要进展,首次实现了联烯碳的不对称烯丙基化反应,为构建具有良好立体选择性的兼具轴手性和中心手性元素的四取代联烯化合物提供了简洁、高效的合成方法,相应研究成果发表在《德国应用化学》(Angewandte Chemie International Edition, DOI: 10.1002/anie.202009460)上,并被选为VIP(Very Important Paper)和扉页文章。 
轴手性联烯常见于天然产物、生物活性分子以及手性催化剂。与此同时,联烯本身的特殊结构和反应性也使它在功能材料和有机合成中扮演了重要角色。因此,轴手性联烯的合成历来受到化学家们的关注。 在天然产物和生物活性分子的合成中,烯丙基化反应是构建碳-碳键的重要手段,其不对称版本在提升分子的复杂程度的基础上更是能为非手性、前手性或外消旋的原料直接引入手性元素。我们所熟知的Tsuji-Trost烯丙基化反应以及基于Morita–Baylis–Hillman(MBH)型原料的烯丙基化反应便是其中的代表。但是此前构建碳碳键的不对称烯丙基化反应一般发生在带有强吸电子基团的饱和碳中心上,直接在联烯的不饱和碳中心上发生的不对称烯丙基化反应还未被成功实现。 在这种背景下,郭红超教授课题组采用有机小分子催化,成功实现了不饱和碳的不对称烯丙基化,将烯丙基引入三取代联烯,高效合成了多个具有轴手性和叔碳立体中心的四取代手性联烯。 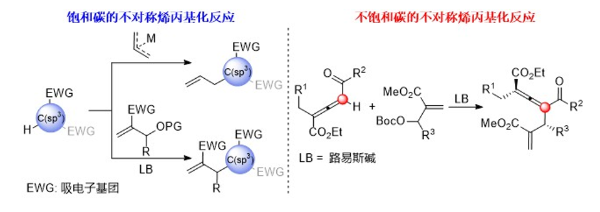
在最佳反应条件下,作者对三取代联烯和MBH碳酸酯分别进行了考察,绝大多数底物都能以高产率、极佳的非对映选择性和优异的对映选择性完成反应,提供新型的四取代手性联烯,显示了很好的底物兼容性,而且投料放大反应也没有问题。产物中丰富的活性官能团如碳碳双键、酯基、酮羰基为产物的进一步修饰转化提供了各种可能,可方便得到各种衍生化产品。 
对于该不对称烯丙基化反应,作者也建议了可能的反应机理。路易斯碱催化剂首先对MBH碳酸酯加成形成季铵盐A,同时产生二氧化碳和叔丁氧负离子;叔丁氧负离子作为强碱脱去联烯氢形成联烯碳负离子B,之后B对中间体A的Re面进行亲核加成产生中间体C,这是形成手性产物的关键步骤,终产物由中间体C形成并伴随着催化剂再生。 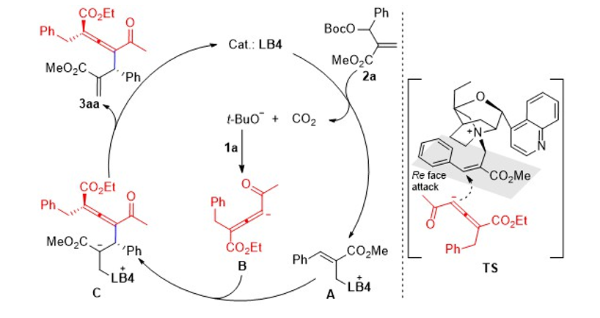
郭红超教授课题组以新农药创制为导向,一直致力于金属及有机小分子催化剂催化的不对称反应特别是环加成反应的研究,目前已发展了多个新型高效的不对称催化反应,这项工作是该课题组在不对称催化领域取得的又一重要成果。理学院博士研 究生胡益敏为该项工作的第一作者。项目研究得到了国家自然科学基金委和基本科研业务费的资助。
|